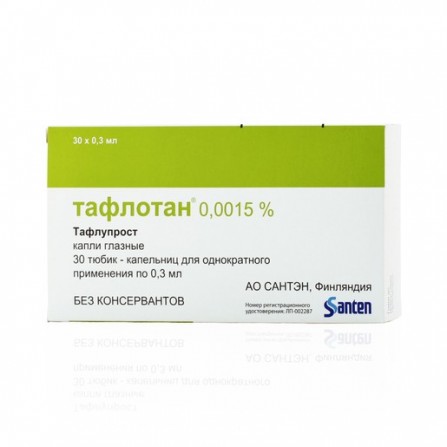
Taflotan Auge fällt 0,0015% 0,3 ml N30
Condition: New product
978 Items
Bewertung:
Schreiben Sie die erste Bewertung!

More info
Wirkstoffe
Tafluprost
Formular freigeben
Tropfen
Zusammensetzung
1 ml Augentropfen enthält: Wirkstoffe: tafluprost 15 μg; Hilfsstoffe: Glycerin - 22,5 mg, Natriumhydrogenphosphatdihydrat - 2 mg, Dinatriumedetat - 0,5 mg, Polysorbat 80 - 0,75 mg, Salzsäure und / oder Natriumhydroxid (zur pH-Korrektur), Wasser d / und bis zu 1 ml;
Pharmakologische Wirkung
Antiglaukom-Medikament, fluoriertes Prostaglandin F2-Analogon. Der Wirkmechanismus. Tafluprost-Säure hat als biologisch aktiver Metabolit eine hohe Aktivität und Selektivität für den menschlichen FP-Prostanoidrezeptor. Die Affinität von Tafluprost-Säure zum FP-Rezeptor ist 12-fach höher als die von Latanoprost. Pharmakodynamische Studien an Affen haben gezeigt, dass Tafluprost den Augeninnendruck (IOP) reduziert und den uveoskleralen Abfluss von Kammerwasser erhöht. Pharmakodynamische Wirkung. Experimente an Affen mit normalem und erhöhtem IOP haben gezeigt, dass Tafluprost ein wirksames Medikament zur Reduzierung des IOP ist. In einer Studie zum IOD-senkenden Effekt von Tafluprost-Metaboliten wurde festgestellt, dass nur Tafluprost-Säure den IOD signifikant reduziert. Studien an Kaninchen, die 4 Wochen mit ophthalmologischer Tafluprost-Lösung (0,0015% 1 Mal / Tag) behandelt wurden, zeigten, dass der Blutfluss in der Papille verläuft Die Nervenwerte (15%) waren im Vergleich zum Ausgangswert signifikant erhöht, wenn sie am 14. und 28. Tag mit der Laser-Speckle-Fluographie gemessen wurden. Klinischer Effekt. Die Reduzierung des Augeninnendrucks beginnt innerhalb von 2-4 Stunden nach der ersten Installation des Arzneimittels und die maximale Wirkung wird in etwa 12 Stunden erreicht. Die Wirkung hält mindestens 24 Stunden an. Führende Studien zur Verwendung von Tafluprost, das das Konservierungsmittel Benzalkoniumchlorid enthält, zeigten dies Tafluprost ist als Monotherapie wirksam und wirkt additiv, wenn es als adjuvante Therapie zu Timolol eingesetzt wird. Die 6-monatige Studie zeigte eine signifikante IOP-senkende Wirkung von Tafluprost zu verschiedenen Tageszeitpunkten: von 6 bis 8 mm Hg. Art., Verglichen mit Latanoprost, Verringerung des IOP um 7 bis 9 mm Hg. st. In einer weiteren 6-monatigen klinischen Studie reduzierte Tafluprost den IOD um 5–7 mm Hg.Art. Und Timolol bei 4-6 mm Hg. st. Der IOD-senkende Effekt von Tafluprost hielt auch bei einer Verlängerung der Studiendauer auf 12 Monate an. In einer 6-wöchigen Studie wurde der IOP-senkende Effekt von Tafluprost mit dem Effekt seines indifferenten Füllstoffs verglichen, wenn er zusammen mit Timolol angewendet wurde. Verglichen mit dem Ausgangswert (gemessen nach 4-wöchiger Behandlung mit Timolol) betrug der zusätzliche IOP-senkende Effekt 5-6 mm Hg. st. in der Timolol-Tafluprost-Gruppe und 3-4 mm Quecksilber. st. - in der Gruppe der Timolol-indifferenten Füllstoffe. In einer kleinen Querschnittsstudie mit einer vierwöchigen Behandlungsdauer wurde ein ähnlicher IOP-senkender Effekt der Dosierungsformen mit einem Konservierungsmittel und ohne Konservierungsmittel nachgewiesen - mehr als 5 mm Hg. In einer 3-monatigen Studie in den Vereinigten Staaten wurde beim Vergleich der Zusammensetzung von Tafluprost ohne Konservierungsmittel mit Timolol, auch ohne Konservierungsmittel, festgestellt, dass Tafluprost den IOP um 6,2 bis 7,4 mm Hg verringerte. zu verschiedenen Zeitpunkten, während die Werte für Timolol zwischen 5,3 und 7,5 mm Hg variierten;
Pharmakokinetik
Resorption: Nach dem Aufbringen von Augentropfen, 0,0015% in einem Röhrchen-Dropper, ohne Konservierungsmittel, einmal täglich einen Tropfen auf beide Augen für 8 Tage, waren seine Plasmakonzentrationen niedrig und hatten am Tag 1 und 8 ein ähnliches Profil . Die Plasmakonzentrationen erreichten ein Maximum von 10 Minuten nach der Installation und fielen weniger als eine Stunde nach der Verabreichung des Arzneimittels auf ein Niveau unterhalb der unteren Nachweisgrenze (10 pg / ml). Die Mittelwerte von Cmax (26,2 und 26,6 pg / ml) und AUCo-last (394,3 und 431,9 pg / min / ml) waren an den Tagen 1 und 8 nahezu gleich, was darauf hinweist, dass die erste Woche der Behandlung stabil war Medikamentenkonzentration. Es wurden keine statistisch signifikanten Unterschiede in der systemischen Bioverfügbarkeit zwischen Dosierungsformen mit Konservierungsmittel und ohne Konservierungsmittel gefunden In einer Studie an Kaninchen war die Resorption von Tafluprost in Kammerwasser nach einmaliger Verabreichung von ophthalmischem Tafluprost 0,0015% mit Konservierungsmittel und ohne Konservierungsmittel vergleichbar Verteilung; Bei der Untersuchung von Affen wurde keine spezifische Verteilung von radioaktiv markiertem Tafluprost in der Iris, im Ziliarkörper oder in der Aderhaut beobachtet.einschließlich des retinalen Pigmentepithels, was auf eine geringe Affinität des Arzneimittels für das Melaninpigment hinweist. Eine autoradiographische Studie an Ratten zeigte, dass die höchste Konzentration an Radioaktivität in der Hornhaut beobachtet wurde, gefolgt von den Augenlidern, der Sklera und der Iris. Die Radioaktivität breitete sich systematisch auf den Tränenapparat, den Gaumen, die Speiseröhre, den Gastrointestinaltrakt, die Nieren, die Leber und die Gallenblase aus. Die In-vitro-Bindung von Tafluprost-Säure an Humanserumalbumin beträgt 99% für 500 ng / ml Tafluprost-Säure .; Biotransformation; Der Haupt-Stoffwechselweg von Tafluprost im menschlichen Körper, der in vitro getestet wurde, ist die Hydrolyse, um einen pharmakologisch aktiven Metaboliten, Tafluprost-Säure, zu bilden, der dann durch Glucuronid metabolisiert wird oder Beta-Oxidation unter Bildung von pharmakologisch inaktiven 1,2-Dinor- und 1,2,3,4-Tetranor-Tafluprost-Säuren, die glucuronidiert oder hydroxyliert werden können. Das Enzymsystem Cytochrom P450 (CYP) ist nicht am Metabolismus von Tafluprost-Säure beteiligt. In einer Studie, die an Kaninchen-Hornhaut mit verfeinerten Enzymen durchgeführt wurde, wurde festgestellt, dass Carboxylesterase die Hauptesterase ist, die für die Esterhydrolyse von Tafluprost-Säure verantwortlich ist. Butyrylcholinesterase, nicht aber Acetylcholinesterase, kann auch die Hydrolyse fördern. Exkretion: In einer Studie an Ratten wurden nach einmaliger Verabreichung von 3H-Tafluprost (0,005% ige ophthalmische Lösung, 5 μl / Auge) 21 Tage in beiden Augen etwa 87% der gesamten Radioaktivität Dosen wurden im Stuhl nachgewiesen. Ungefähr 27–38% der Gesamtdosis wurden im Urin ausgeschieden und etwa 44–58% mit Kot;
Hinweise
Zur Verringerung des Augeninnendrucks bei Patienten mit Offenwinkelglaukom und ophthalmischer Hypertonie als Monotherapie bei Patienten: - die bei Augentropfen angezeigt werden, die kein Konservierungsmittel enthalten; - mit unzureichender Reaktion auf Medikamente der ersten Wahl; - keine Medikamente der ersten Wahl oder Kontraindikationen zu diesen Medikamenten haben; als zusätzliche Therapie gegen Betablocker. ; Tafluprost ist für Patienten über 18 Jahre bestimmt.
Gegenanzeigen
Überempfindlichkeit gegen Tafluprost oder einen der inerten Füllstoffe Taflotan;
Anwendung während der Schwangerschaft und Stillzeit
Daten zur Anwendung von Tafluprost bei schwangeren Frauen reichen nicht aus. Tafluprost kann sich nachteilig auf den Verlauf der Schwangerschaft und / oder auf den Fötus / das Neugeborene auswirken. In dieser Hinsicht sollte Taflotan während der Schwangerschaft nicht angewendet werden, es sei denn, es gibt keine anderen Behandlungsmöglichkeiten. Frauen im gebärfähigen Alter sollten Taflotan nicht verschrieben werden, wenn sie keine angemessenen Verhütungsmittel verwenden. Es ist nicht bekannt, ob Tafluprost oder seine Metaboliten in die Muttermilch übergehen persönlich Taflotan sollte während der Stillzeit nicht angewendet werden; In Tierversuchen wurden die toxischen Wirkungen von Tafluprost auf das Fortpflanzungssystem nachgewiesen. In einer Studie an Ratten wurde festgestellt, dass Tafluprost nach topischer Verabreichung in die Muttermilch übergeht. Fertilität bei weiblichen und männlichen Ratten, Paarungsfähigkeit und Fertilität blieben unverändert mit der Einführung von Tafluprost auf 100 µg / kg / Tag / v
Dosierung und Verabreichung
Die empfohlene Dosis beträgt einmal täglich abends einen Tropfen Taflotan-Augentropfen in den Bindehautsack der betroffenen Augen .; Die Dosis sollte einmal täglich strengstens angewendet werden, da eine häufigere Anwendung die Wirkung des Augeninnendrucks verringern kann. Nur bei einmaliger Anwendung . Der Inhalt einer Tube-Dropper reicht für beide Augen aus. Das verbleibende Arzneimittel sollte unmittelbar nach der Verwendung weggeworfen werden. Anwendung bei älteren Patienten Bei der Behandlung älterer Patienten ist keine Dosisänderung erforderlich; Verwendung bei Kindern und Jugendlichen; Die Unbedenklichkeit und Wirksamkeit von Tafluprost bei Kindern und Jugendlichen unter 18 Jahren ist nicht belegt. Keine Daten verfügbar; Verwendung bei Nieren- / Leberfunktionsstörungen. Es wurden keine Studien zu den Auswirkungen von Tafluprost auf Patienten mit Nieren- / Lebererkrankungen durchgeführt. Daher sollte bei der Behandlung dieser Kategorie von Patienten Vorsicht geboten werden. Anwendungsverfahren; Entfernen Sie überschüssige Lösung von der Haut. Wie bei anderen Augentropfen wird eine nasolacrimale Okklusion empfohlen - sanftes Schließen der Augenlider nach der Installation des Arzneimittels.Dies kann die systemische Absorption von Medikamenten, die durch die Augen verabreicht werden, verringern. Bei der Verwendung mehrerer lokaler Augenarzneimittel sollten die Intervalle zwischen ihrer Anwendung mindestens 5 Minuten betragen;
Nebenwirkungen
In klinischen Studien wurden über 1400 Patienten mit Tafluprost mit einem Konservierungsmittel behandelt - entweder als Monotherapie oder als zusätzliches Medikament zur Behandlung mit Timolol (0,5%). Die am häufigsten festgestellte behandlungsbedingte Nebenwirkung war das Augenduschen. Es wurde bei etwa 13% der Patienten beobachtet, die an klinischen Studien mit Tafluprost in Europa und den USA teilgenommen haben. In den meisten Fällen war die Hyperämie mäßig und führte bei durchschnittlich 0,4% der Patienten zum Abbruch der Behandlung. In einer dreimonatigen Phase-III-Studie in den USA wurde beim Vergleich der Zusammensetzung von Tafluprost 0,0015% ohne Konservierungsmittel, mit Timolol, auch ohne Konservierungsmittel, bei 4,1% (13/320) der Patienten, die Tafluprost erhielten, Augenhyperämie beobachtet. Während der klinischen Tafluprost-Studien wurden in Europa und den Vereinigten Staaten nach einer maximalen Ausdehnung von bis zu 24 Monaten die folgenden mit der Behandlung verbundenen Nebenwirkungen berichtet: Ophthalmic (häufig: von> 1/100 bis <1/10): Juckreiz der Augen, Augenreizung, Schmerz Bindehaut- / Augenhyperämie, Wimpernveränderungen (Zunahme der Länge, Dicke und Anzahl der Wimpern), Syndrom des trockenen Auges, Fremdkörpergefühl in den Augen, Veränderung der Wimpernfarbe, Erythem der Augenlider, oberflächliche Keratitis punctata, Photophobie, vermehrtes Reißen, verschwommen nicht sehen, verminderte Sehschärfe und erhöhte Pigmentierung der Iris; selten (von> 1/1000 bis <1/100): Augenlidpigmentierung, Augenlidödem, Asthenopie, Bindehautödem, Augenausfluss, Blepharitis, Entzündung der vorderen Kammer , Beschwerden in den Augen, anteriore Augenkammervenen, konjunktivale Pigmentierung, konjunktivale Follikel, allergische Konjunktivitis und atypische Empfindung im Auge .; Erkrankungen des Nervensystems; Häufig (von> 1/100 bis <1/10): Kopfschmerzen; Haut und Unterhautgewebe; seltenes Treffen Esja (von> 1/1000 bis <1/100): Hypertrichose Jahrhundert;
Überdosis
Symptome: Es gab keine Berichte über Fälle von Überdosierung. Nach Instillation des Arzneimittels im Auge Überdosis; unwahrscheinlich Im Falle einer Überdosierung sollte die Behandlung symptomatisch sein;
Wechselwirkung mit anderen Drogen
Es sind keine Wechselwirkungen mit anderen Arzneimitteln zu erwarten, da die systemischen Konzentrationen von Tafluprost nach dem Eintropfen des Arzneimittels im Auge extrem niedrig sind. Es wurden keine speziellen Studien zur Untersuchung spezifischer Kreuzwechselwirkungen von Tafluprost mit anderen Arzneimitteln durchgeführt: In klinischen Studien wurde Tafluprost gleichzeitig mit Timolol angewendet, und es wurden keine Anzeichen einer Kreuzwechselwirkung beobachtet;
Besondere Anweisungen
Vor der Behandlung sollten die Patienten vor einem übermäßigen Wimpernwachstum, einer Verdunkelung der Augenlidhaut und einer erhöhten Pigmentierung der Iris gewarnt werden. Einige dieser Veränderungen können dauerhaft sein, und dies kann zu Unterschieden im Aussehen des Auges führen, wenn nur ein Auge behandelt wurde. Die Veränderung der Pigmentierung der Iris tritt langsam ein und kann über mehrere Monate unmerklich bleiben. Die Veränderung der Augenfarbe wird hauptsächlich bei Patienten mit gemischten Irisiris beobachtet, beispielsweise wenn die Augen braunblau, graubraun, gelbbraun oder grünbraun sind. Das Risiko einer lebenslangen Heterochromie ist wahrscheinlich, wenn nur ein Auge behandelt wird.Es gibt keine Erfahrungen mit Tafluprost bei neovaskulärem, Winkelschluss-, Engwinkel- oder angeborenem Glaukom. Es gibt nur begrenzte Erfahrungen Behandlung Tafluprost Patienten mit Aphakie, Pigment oder Pseudoexfoliationsglaukom Glaukom ;. Empfohlene Vorsicht bei der Behandlung Tafluprost Patienten mit Aphakie, Pseudophakie, beschädigte hintere Kapsel der Linse oder Linsenvorderkammer oder Patienten mit bekannten Risikofaktoren für zystoides Makulaödem oder Iritis / Uveitis Es gibt keine Erfahrungen mit dem Medikament bei Patienten mit schwerem Asthma. In dieser Hinsicht sollten Patienten in dieser Gruppe mit Vorsicht behandelt werden. Es wurde berichtet, dass Benzalkoniumchlorid, das normalerweise als Konservierungsmittel in ophthalmischen Zubereitungen verwendet wird, punktuelle Keratopathie und / oder toxische ulzerative Keratopathie verursacht. Da Taflotan Benzalkoniumchlorid in Durchstechflaschen enthält, ist bei häufigem oder längerem Gebrauch bei Patienten mit trockenen Augen sowie bei Hornhautgefahren eine sorgfältige Überwachung erforderlich. Kontakt des Medikaments mit weichen Kontaktlinsen sollte vermieden werden.Entfernen Sie Kontaktlinsen, bevor Sie das Medikament verwenden, und setzen Sie sie erst 15 Minuten nach der Instillation erneut ein .; Wie bei der Verwendung anderer ophthalmologischer Wirkstoffe kann nach der Installation des Arzneimittels eine kurzzeitige verschwommene Sicht auftreten. In diesem Fall muss der Patient warten, bis das Sehvermögen vollständig wiederhergestellt ist, und erst danach ein Auto fahren oder mechanische Geräte bedienen;
Verschreibung
Ja