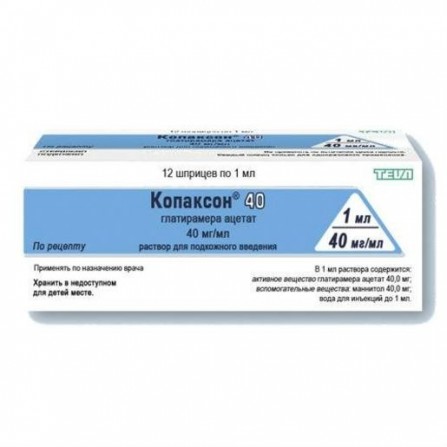
Copaxone 40teva solución de inyección subcutánea vv40mg / ml 1ml N12
Condition: New product
1000 Items

More info
Descripción
Solución ligeramente opalescente de incoloro a amarillo claro.
Ingredientes activos
Formulario de liberación
Efecto farmacologico
Acción farmacológica - inmunomoduladora..
El mecanismo de acción del acetato de Glatiramer en pacientes con esclerosis múltiple no se conoce completamente. Se cree que el acetato de glatiramer altera los procesos inmunes que se cree que desempeñan un papel importante en la patogénesis de la esclerosis múltiple. Esta hipótesis se confirma por los resultados de los estudios realizados para estudiar la patogenia de la encefalomielitis alérgica experimental (EAE). EAE se utiliza a menudo como un modelo experimental de esclerosis múltiple. Los estudios en animales y en pacientes con esclerosis múltiple han demostrado que la administración de acetato de Glatiramer causa la inducción periférica y la activación de los linfocitos T supresores de acetato de Glatiramer.
Esclerosis múltiple recurrente-remitente. Los resultados de un estudio controlado con placebo de 12 meses confirmaron la eficacia de Copaxone® 40 en una dosis de 40 mg / ml para la administración sc 3 veces por semana para reducir la frecuencia de las exacerbaciones.
Al realizar un ensayo clínico de registro, el criterio para la inclusión de pacientes con esclerosis múltiple remitente recurrente fue al menos una exacerbación clínica documentada en los últimos 12 meses o 2 exacerbaciones en los últimos 24 meses, o una exacerbación en los últimos 12-24 meses con al menos una Los focos acumulan contraste (Gd +) y se representan en imágenes MRI ponderadas en T1 durante los últimos 12 meses.
El objetivo principal del estudio fue determinar el número total de exacerbaciones confirmadas. El objetivo secundario es determinar el número acumulativo de focos nuevos / aumentados detectados en las imágenes de IRM ponderadas en T2, y el número acumulativo de focos que acumulan contraste y se visualizan en las imágenes ponderadas en T1 en los 6º y 12º meses del estudio.
El estudio se asignó al azar a 1404 pacientes en una proporción de 2: 1 al grupo tratado con Copaxone® 40 en una dosis de 40 mg / ml (n = 943), o al grupo de placebo (n = 461), respectivamente. Ambos grupos fueron comparables en términos de indicadores demográficos de referencia, características del curso de la esclerosis múltiple y parámetros de MRI.Los pacientes tuvieron un promedio de 2 exacerbaciones durante los 2 años anteriores a la selección.
En comparación con el grupo placebo, los pacientes tratados con Copaxone® 40 a una dosis de 40 mg / ml 3 veces a la semana, hubo una disminución estadísticamente significativa en la frecuencia de exacerbaciones y el número total de focos en imágenes ponderadas en T2 y focos que acumulan contraste en imágenes ponderadas en T1 que corresponde al efecto terapéutico del medicamento Copaxone®-Teva 20 mg / ml con su administración diaria.
En el marco de este estudio no se realizó un análisis comparativo directo de la eficacia y seguridad del fármaco a una dosis de 20 mg / ml (con administración diaria) y 40 mg / ml (con 3 veces por semana).
Durante este estudio de 12 meses, no hubo evidencia del efecto del fármaco sobre la progresión de la discapacidad o la duración de las exacerbaciones. Actualmente no hay datos sobre el uso del fármaco en pacientes con esclerosis múltiple progresiva primaria o secundaria.
Farmacocinética
No se han realizado estudios farmacocinéticos en pacientes.
Los datosin vitroAdemás, los datos limitados obtenidos con la participación de voluntarios sanos muestran que con la inyección sc, el principio activo se absorbe rápidamente y la mayor parte se descompone en pequeños fragmentos en el tejido subcutáneo.
Datos preclínicos
Los datos preclínicos basados en estudios de seguridad farmacológica, toxicidad de administración repetida, toxicidad reproductiva, genotoxicidad o carcinogenicidad no indican la presencia de factores dañinos específicos para una persona que no sean los datos ya incluidos en las secciones de esta preparación. Debido a la falta de datos sobre la farmacocinética, es imposible determinar los límites de concentración permisibles en humanos en comparación con los animales. En un pequeño número de ratas y monos que fueron inyectados con el medicamento durante al menos 6 meses, hubo una deposición de complejos inmunes en los glomérulos. En un estudio de 2 años en ratas, no hubo deposición de complejos inmunes en los glomérulos.
En animales sensibilizados (cobayas y ratones), se observó anafilaxis después de la administración del fármaco. La relevancia de estos datos es desconocida para los humanos.Los efectos tóxicos en el lugar de la inyección después de la administración repetida del medicamento a los animales se refieren a reacciones comunes.
Indicaciones
Esclerosis múltiple recurrente-remitente.
Contraindicaciones
hipersensibilidad al acetato de glatiramer o manitol;
embarazo
La edad infantil hasta 18 años (eficiencia y seguridad no estudiadas).
Con cuidado predisposición al desarrollo de reacciones alérgicas; enfermedades cardiovasculares; Función renal alterada.
Uso durante el embarazo y la lactancia.
No hay datos sobre el uso de Copaxone® 40 durante el embarazo, no se ha establecido el posible riesgo de uso durante el embarazo.
Los estudios en animales son insuficientes para establecer el efecto del fármaco en el embarazo, el desarrollo del embrión / feto, el parto y el desarrollo postnatal. El medicamento Copaxone 40 está contraindicado durante el embarazo. Durante el tratamiento, debe utilizar métodos anticonceptivos confiables.
No se sabe si el acetato de Glatiramer se excreta en la leche materna, por lo que si necesita usar Copaxone® 40 durante la lactancia, debe evaluar los beneficios esperados de la terapia para la madre y el riesgo potencial para el niño.
Posología y administración.
S / c, 40 mg del medicamento Copaxone® 40 (una jeringa con solución inyectable) 3 veces a la semana, el intervalo mínimo entre inyecciones es de 48 horas. El medicamento no está diseñado para administración intravenosa o intramuscular.
Actualmente, los datos sobre la duración del tratamiento no están disponibles. La decisión sobre la designación de un tratamiento prolongado debe ser tomada por el médico tratante en cada caso.
Se recomienda a los pacientes que se entrenen en tecnología de autoinyección. La primera inyección (y 30 minutos después) debe ser supervisada por un especialista calificado. Para reducir el riesgo de irritación o dolor en el área de la inyección, es necesario cambiar el área de inyección cada vez.
Cada jeringa con el medicamento Copaxone® 40 está diseñada para un solo uso.
Recomendaciones para pacientes sobre el uso de la droga.
1. Asegúrese de que el paciente tenga todo lo necesario para la inyección: una jeringa desechable llena con una solución de Copaxone® 40, un recipiente para jeringas usadas, un algodón humedecido con alcohol.
2Antes de la inyección, retire la jeringa desechable del embalaje de la tira blister, retirando la tira protectora de papel.
3. Sostenga la jeringa con la solución a temperatura ambiente durante al menos 20 minutos.
4. Antes de administrar Copaxone® 40, lávese bien las manos con agua y jabón.
5. Inspeccione cuidadosamente la solución en la jeringa. En presencia de partículas suspendidas o cambios de color de la solución, no debe utilizarse.
6. Elija un sitio de inyección.
Las zonas posibles para inyecciones independientes están marcadas en la fig. 1: brazos, muslos, glúteos, estómago (aproximadamente 5 cm alrededor del ombligo). No inyecte en puntos doloridos, descoloridos, enrojecidos o en áreas con sellos y nódulos. Dentro de cada zona de inyección hay suficiente espacio para múltiples inyecciones. Se recomienda hacer un esquema de sitios de inyección y tenerlo con usted. Para las inyecciones en las nalgas y los brazos, el paciente puede necesitar la ayuda de otra persona.
Figura 1. Ubicación de los sitios de inyección.
7. Retire la tapa protectora de la aguja.
8. Trate previamente el lugar de la inyección con un algodón humedecido con una solución de alcohol y doble ligeramente la piel en el pliegue con el pulgar y el índice (Fig. 2).
Figura 2.
9. Colocar la aguja de la jeringa perpendicular al lugar de la inyección (Fig. 3), perforar la piel y presionar uniformemente el émbolo de la jeringa, inyectar su contenido en el lugar de la inyección.
Figura 3.
10. Retire la aguja moviendo la jeringa perpendicular al lugar de la inyección.
11. Coloque la jeringa en un recipiente para jeringas usadas.
Si el paciente se olvidó de inyectar Copaxone® 40, se debe administrar una inyección inmediatamente, tan pronto como el paciente lo recuerde. No se puede introducir una dosis doble del medicamento.
Grupos especiales de pacientes
Los niños No se recomienda el uso del medicamento en pacientes menores de 18 años, ya que no se han realizado estudios clínicos en estos grupos de edad.
La vejez No se ha estudiado la eficacia y seguridad del fármaco en ancianos.
Deterioro de la función renal. No se ha estudiado la eficacia y seguridad del fármaco en pacientes con insuficiencia renal.
Efectos secundarios
La mayoría de los datos de seguridad sobre el uso de Copaxone® 40 se han acumulado sobre la base del uso de Copaxone®-Teva 20 mg / ml en forma de inyecciones diarias. Esta sección presenta datos acumulados durante 4 estudios clínicos controlados con placebo sobre el uso de Copaxone®-Teva como inyección sc en una dosis de 20 mg / ml 1 vez por día y 1 estudio controlado con placebo sobre el uso de Copaxone® 40 en forma de inyecciones de s / c en una dosis de 40 mg / ml 3 veces a la semana.Copaxone®-Teva 20 mg / ml (se usa diariamente).
Más a menudo durante los estudios clínicos del medicamento Copaxone®-Teva, se observaron reacciones en el lugar de la inyección. Un estudio controlado con placebo mostró que la proporción de pacientes que informaron estos eventos adversos fue al menos 1 vez, 70% para Copaxone®-Teva y 37% para placebo. Los síntomas más comunes fueron enrojecimiento, dolor, induración, picazón, hinchazón, inflamación e hipersensibilidad.
Una reacción asociada con al menos uno o más síntomas (vasodilatación, dolor de pecho, dificultad para respirar, palpitaciones del corazón o taquicardia) que se produce unos minutos después de la inyección se denomina reacción inmediata posterior a la inyección. Al menos uno de los síntomas de esta reacción se observó al menos una vez en el 31% de los pacientes que recibieron Copaxone®-Teva, en comparación con el 13% de los pacientes del grupo placebo.
A continuación se presentan todas las reacciones adversas que se observan con más frecuencia en pacientes que reciben Copaxone®-Teva en comparación con el grupo de placebo. Estos datos se obtuvieron en el curso de 4 estudios doble ciego, controlados con placebo, que incluyeron 512 pacientes que recibieron Copaxone®-Teva diariamente y 509 pacientes que recibieron placebo durante 36 meses. En 3 estudios, 269 pacientes fueron diagnosticados con esclerosis múltiple remitente recurrente que recibieron Copaxone®-Teva diariamente durante 35 meses y 271 pacientes del grupo de placebo. En el cuarto estudio, 243 pacientes participaron (grupo Kopakson®-Teva) con el primer episodio clínico de la enfermedad, que tenían un alto riesgo de desarrollar esclerosis múltiple clínicamente confirmada, y 238 pacientes que recibieron placebo. La duración del estudio fue de 36 meses.
La incidencia de reacciones adversas se clasifica de la siguiente manera: muy a menudo (≥1 / 10); a menudo (≥1 / 100, pero <1/10); con poca frecuencia (≥1 / 1000, pero <1/100): rara vez (≥1 / 10000, pero <1/1000).
Infecciones e invasiones: muy a menudo - infecciones, gripe; a menudo - bronquitis, gastroenteritis, otitis media,Herpes simple, rinitis, absceso periodontal, candidiasis vaginal *; con poca frecuencia - absceso, inflamación de la grasa subcutánea, furunculosis, pielonefritis,Herpes zoster.
Neoplasias, incluyendo pólipos y quistes: a menudo - neoplasias cutáneas benignas, neoplasias; con poca frecuencia - cáncer de piel.
Desde los sistemas hematopoyético y linfático: a menudo - linfadenopatía *; con poca frecuencia - leucocitosis, leucopenia, esplenomegalia, trombocitopenia, cambios en la morfología de los linfocitos.
Por parte del sistema inmunológico: a menudo - reacciones de hipersensibilidad.
Por parte del sistema endocrino: Con poca frecuencia - bocio, hipertiroidismo.
Metabolismo y nutrición: a menudo - anorexia, aumento de peso *; con poca frecuencia: intolerancia al alcohol, gota, hiperlipidemia, hipernatremia, disminución de la concentración de ferritina en el suero sanguíneo.
Trastorno mental: muy a menudo - ansiedad *, depresión; a menudo - nerviosismo; con poca frecuencia - sueños inusuales, psicosis, euforia, alucinaciones, agresividad, manía, trastornos de personalidad, intentos suicidas.
Desde el sistema nervioso: muy a menudo - un dolor de cabeza; a menudo - perversión del gusto, hipertonicidad de los músculos, migraña, trastornos del habla, desmayos, temblor *; con poca frecuencia - síndrome del túnel carpiano, trastornos cognitivos, convulsiones, disografía, dislexia, distonía, funciones motoras deterioradas, mioclono, neuritis, bloqueo neuromuscular, nistagmo, parálisis, Nervio peroneo, estupor, defecto del campo visual.
De los órganos de la visión: a menudo - diplopía, discapacidad visual *; con poca frecuencia: cataratas, daño corneal, esclerótica seca y córnea, hemorragia ocular, ptosis del párpado, midriasis, atrofia del nervio óptico.
Desde el lado de la audición y el equilibrio: a menudo - discapacidad auditiva.
Desde el CCC: muy a menudo - vasodilatación *; a menudo - palpitaciones *, taquicardia *; con poca frecuencia: extrasístole, bradicardia sinusal, taquicardia paroxística, venas varicosas.
Por parte del sistema respiratorio: muy a menudo - falta de aliento *; a menudo - tos, rinitis estacional; con poca frecuencia - apnea, sensación de asfixia, epistaxis, hiperventilación, laringismo, trastornos pulmonares.
Desde el tracto digestivo: muy a menudo - náuseas *; a menudo - trastornos anorrectales, estreñimiento, caries, dispepsia, disfagia, incontinencia fecal, vómitos *; con poca frecuencia: colitis, enterocolitis, poliposis de colon, eructos, úlcera péptica esofágica, periodontitis, sangrado rectal, glándulas salivales agrandadas.
Hígado y tracto biliar: a menudo - desviación de las pruebas de función hepática; con poca frecuencia - colelitiasis, hepatomegalia.
Por parte de la piel y grasa subcutánea: muy a menudo - erupción cutánea *; a menudo - equimosis, hiperhidrosis, prurito, enfermedades de la piel *, urticaria; con poca frecuencia - angioedema, dermatitis de contacto, eritema nodoso, nódulos de la piel.
Desde el sistema musculoesquelético y el tejido conectivo: muy a menudo - artralgia, dolor de espalda *; a menudo - dolor de cuello; con poca frecuencia - artritis, bursitis, dolor en el costado, atrofia muscular, artrosis.
Por parte de los riñones y sistema urinario: a menudo - impulsos imperativos, pollakiuria, retención urinaria; con poca frecuencia - hematuria, nefrolitiasis, enfermedades del tracto urinario, desviaciones de la prueba de orina.
Embarazo, posparto y condiciones perinatales: Con poca frecuencia - aborto espontáneo.
De los órganos genitales y mamarios: con poca frecuencia: congestión mamaria, disfunción eréctil, prolapso de órganos pélvicos, priapismo, enfermedades de la próstata, anomalías en los frotis del canal cervical, disfunción testicular, sangrado vaginal, trastornos vulvovaginales
Otros: muy a menudo - astenia, dolor de pecho *, reacciones en el lugar de la inyección *, **, dolor *; a menudo - escalofríos *, cara *, atrofia en el lugar de la inyección ***, reacciones locales *, edema periférico, edema, fiebre; con poca frecuencia: hipotermia, reacción inmediata posterior a la inyección, inflamación, quiste, resaca, enfermedades de la mucosa, síndrome posterior a la vacunación, necrosis en el lugar de la inyección.
* La probabilidad de que ocurran estos casos en pacientes que toman Copaxone®-Teva es más del 2% (> 2/100) en comparación con el grupo de placebo. Una reacción indeseable sin el signo "*" indica una diferencia menor o igual al 2%.
** Las “reacciones en el sitio de inyección (RMI)” (varios tipos) incluyen cualquier evento adverso que ocurra en el sitio de inyección, con la excepción de atrofia y necrosis, que se enumeran por separado.
*** Se refiere a la lipoatrofia localizada en el lugar de la inyección.
Durante el cuarto estudio clínico indicado anteriormente, una fase abierta del estudio siguió a la fase controlada con placebo, que duró 5 años. Durante este estudio, no se detectaron cambios en el perfil de seguridad previamente establecido de Copaxone®-Teva.
En pacientes con esclerosis múltiple que recibieron Copaxone®-Teva al realizar ensayos clínicos no controlados, así como durante el período de uso posterior a la comercialización, hubo casos raros (≥1 / 10000, pero <1/1000) de reacciones anafilácticas.
Copaxone® 40 en una dosis de 40 mg / ml (usado 3 veces a la semana).En un estudio doble ciego controlado por placebo que duró 12 meses, se evaluó la seguridad de Copaxone® 40 en 943 pacientes con un diagnóstico de esclerosis múltiple remitente recurrente en comparación con el grupo placebo, que incluyó 461 pacientes.
En general, en pacientes que tomaron Copaxone® 40 3 veces a la semana, las reacciones indeseables en el lugar de la inyección coincidieron con las observadas con la administración diaria de Copaxone®-Teva 20 mg / ml.
En particular, el RMI y las reacciones inmediatas posteriores a la inyección (NPIR) con la administración de 3 veces a la semana del medicamento Copaxone® 40 se observaron con menos frecuencia que con las inyecciones diarias de Copaxone®-Teva (35.5 comparado con 70% para PMI y 7.8%). en comparación con el 31% - para NPIR, respectivamente).
En el 36% de los pacientes que utilizaron el medicamento Copaxone® 40, en comparación con el 5% de los pacientes que recibieron un placebo, se observó un IMC. En el 8% de los pacientes tratados con Copaxone®40 en comparación con el 2% de los pacientes que tomaron placebo, se detectó NPIR.
Sin embargo, se observaron varias reacciones adversas específicas:
- en pacientes con esclerosis múltiple que recibieron el medicamento Copaxone®-Teva 20 mg / ml al realizar estudios clínicos no controlados, así como en base a los resultados de la experiencia post-comercialización en casos raros (≥1 / 10000, pero <1/1000), se observó una reacción anafiláctica. En los pacientes que tomaron el medicamento Copaxone® 40, estos casos fueron del 0,3% (con poca frecuencia: ≥1 / 1000, pero <1/100);
- no se detectó un solo caso de necrosis en el lugar de la inyección;
- en el 2.1% de los pacientes que recibieron el medicamento Kopakson® 40 (a menudo: ≥1 / 100, pero <1/10), hubo casos de enrojecimiento de la piel y dolor en las extremidades, que no se detectaron al usar el medicamento Kopakson®-Teva 20 mg / ml:
- en un paciente (0,1%) que recibió el medicamento Copaxone® 40 (con poca frecuencia: ≥1 / 1000, pero <1/100), se observaron daños hepáticos inducidos por medicamentos y hepatitis tóxica, que también fueron poco frecuentes en pacientes con esclerosis múltiple que tomó el medicamento Copaxone®-Teva 20 mg / ml durante la vigilancia posterior a la comercialización.
Sobredosis
Recibió varios informes de sobredosis (hasta 300 mg de acetato de glatiramer). No se observaron reacciones adversas, aparte de las enumeradas en la sección "Efectos secundarios".
En caso de sobredosis, se indica observación cuidadosa, tratamiento sintomático y de soporte.
Interacción con otras drogas.
La interacción entre Copaxone® 40 y otros medicamentos no se ha evaluado por separado. No hay datos sobre la interacción con interferón beta.
Un aumento en los casos de reacciones en el lugar de la inyección con la administración simultánea del fármaco Copaxone® 40 con corticosteroides.
En un estudioin vitro Se ha sugerido que el acetato de Glatiramer tiene un alto nivel de asociación con proteínas plasmáticas y no se desplaza de la asociación con proteínas plasmáticas solas, así como fenitoína o carbamazepina. Sin embargo, dado que el medicamento Copaxone® 40 tiene un efecto potencial sobre las sustancias que se unen a las proteínas, es necesario controlar su uso simultáneo con otros medicamentos.
Instrucciones especiales
El inicio del tratamiento con Copaxone® 40 debe realizarse bajo la supervisión de un neurólogo y un médico con experiencia en el tratamiento de la esclerosis múltiple. El fármaco no está indicado para el tratamiento de la esclerosis múltiple progresiva primaria o secundaria.
Los pacientes deben ser informados sobre la posibilidad de reacciones adversas, incluyendo surgido inmediatamente después de la inyección del medicamento Copaxone® 40. La mayoría de estos síntomas son de corta duración y se resuelven espontáneamente sin consecuencias. Con el desarrollo de reacciones adversas graves, debe interrumpir inmediatamente el tratamiento y comunicarse con su médico o llamar a una ambulancia. La decisión sobre el uso de la terapia sintomática es tomada por el médico.
No hay evidencia de que ciertos grupos de pacientes tengan un mayor riesgo de tales reacciones. Sin embargo, los pacientes con enfermedades cardiovasculares deben ser controlados por un médico durante todo el período de tratamiento.
Se han identificado varios casos de convulsiones y / o reacciones anafilácticas o alérgicas. Las reacciones de hipersensibilidad severas (broncoespasmo, reacción anafiláctica o urticaria) también pueden ser raras. En caso de reacciones graves, es necesario prescribir el tratamiento adecuado y dejar de tomar el medicamento. Se detectaron anticuerpos contra el acetato de Glatiramer en el suero de los pacientes. Después de un curso de tratamiento con una duración promedio de 3-4 meses, se registró su concentración máxima, que posteriormente disminuyó y se estabilizó a un nivel justo por encima de la línea de base.
No hay evidencia de que los anticuerpos contra el acetato de Glatiramer tengan un efecto neutralizante o afecten la eficacia clínica del medicamento.
En pacientes con insuficiencia renal, la función renal debe controlarse, aunque no hay pruebas convincentes de que la deposición de complejos inmunes tenga un efecto sobre la filtración glomerular.
Si un paciente no tiene la capacidad de almacenar jeringas con el medicamento Copaxone® 40 en un refrigerador, entonces se permite el almacenamiento a una temperatura de 15–25 ° C, pero no más de 1 mes. Si durante el mes no se usaron jeringas con el medicamento y no se abrió el empaque de la ampolla, entonces estas jeringas deben almacenarse en un refrigerador (2–8 ° C).
Influencia en la capacidad para conducir vehículos y mecanismos.No se realizaron estudios sobre el impacto en la capacidad de conducir vehículos y mecanismos.
Condiciones de almacenamiento
En el lugar oscuro a una temperatura de 2-8 ° C (sin congelación).
Mantener fuera del alcance de los niños.