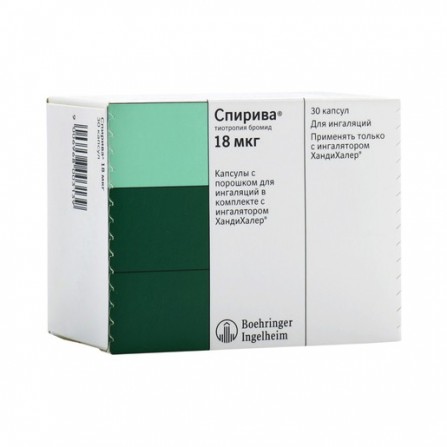
Spiriva capsules avec poudre pour l'inhalation 18mkg N30 + inhalateur
État : Neuf
1000 Produits
Rating:
Be the first to write a review!

En savoir plus
Ingrédients actifs
Bromure de tiotropium
Formulaire de décharge
La solution
La composition
Bromure de tiotropium monohydraté 22,5 mcg, ce qui correspond au contenu en tiotropium 18 mcg; Excipients: lactose monohydraté, 200 M - 5,2025 mg, lactose monohydraté micronisé - 0,2750 mg.
Effet pharmacologique
Bronchodilatateur - bloqueur des récepteurs m-cholinergiques à action prolongée. Il a la même affinité pour différents sous-types de récepteurs muscariniques de M1 à M5. À la suite de l'inhibition des récepteurs M3 dans les voies respiratoires, le muscle lisse se détend. L'effet bronchodilatateur est lié à la dose et dure au moins 24 heures, une durée d'action significative étant probablement associée à une libération très lente de l'association avec les récepteurs M3, par rapport au bromure d'ipratropium. Lorsqu'il est inhalé, le bromure de tiotropium, en tant qu'agent anticholinergique de structure N-quaternaire, a un effet sélectif local, alors qu’à des doses thérapeutiques, il ne provoque pas d’effets secondaires anticholinergiques systémiques. La libération de bromure de tiotropium par la communication avec les récepteurs M2 se produit plus rapidement que par la communication avec les récepteurs M3. La forte affinité pour les récepteurs et la libération lente de leur association avec ceux-ci provoquent un effet bronchodilatateur intense et prolongé chez les patients atteints de BPCO. La bronchodilatation après inhalation de bromure de tiotropium est une conséquence d'effets locaux et non systémiques. Dans les études cliniques, il a été montré que 30 minutes après une seule dose de Spiriva; sur 24 heures, améliore significativement la fonction pulmonaire (augmentation du VEMS et de la CVF). L'équilibre pharmacodynamique a été atteint au cours de la 1ère semaine et un effet bronchodilatateur prononcé a été observé le 3ème jour. Spiriva; augmente significativement le débit expiratoire de pointe du matin et du soir mesuré par les patients. L'effet bronchodilatateur de Spiriva, évalué tout au long de l'année, n'a révélé aucune manifestation de tolérance. Spiriva; réduit considérablement l'essoufflement pendant toute la durée du traitement. Dans deux études randomisées, à double insu et contrôlées par placebo, il a été prouvé que Spiriva; amélioration significative de la tolérance à l'exercice par rapport au placebo; Améliore de manière significative la qualité de vie, qui est observée pendant toute la période de traitement.Spiriva; réduit considérablement le nombre de cas d'hospitalisation associés à une exacerbation de la MPOC et augmente le délai jusqu'à la première hospitalisation; Il a également été montré que Spiriva; conduit à une amélioration soutenue du VEMS après application pendant 4 ans sans modifier le taux de déclin annuel du VEMS.; Pendant le traitement, le risque de décès diminue de 16%. Par rapport à la prise de salmétérol, l'utilisation du médicament Spiriva; augmente le délai avant la première exacerbation (187 jours contre 145), avec une réduction de 17% du risque d'exacerbation (ratio de risque de 0,83; intervalle de confiance [IC] à 95% [IC], de 0,77 à 0,90; P = 0,011). Prenant également le médicament Spiriva; augmente le délai d'apparition de la première exacerbation grave (nécessitant une hospitalisation) (ratio de risque de 0,72; IC à 95% de 0,61 à 0,85; Pnise) de 0,001) réduit le nombre annuel d'exacerbations modérées à graves (nécessitant une hospitalisation) (0,64 contre 0,72; rapport de risque 0,89; IC à 95% de 0,83 à 0,96; p = 0,002) réduit le nombre annuel d'exacerbations graves (nécessitant une hospitalisation) (0,09 contre 0,13; rapport de risque 0,73; IC à 95% de 0,66 à 0,82; P => 0,001).
Pharmacocinétique
Le bromure de tiotropium est un composé d’ammonium quaternaire, peu soluble dans l’eau. La pharmacocinétique du bromure de tiotropium est linéaire dans les limites thérapeutiques après administration in vitro et inhalation de poudre sèche. Absorption: En cas d'inhalation, la biodisponibilité absolue du bromure de tiotropium est de 19,5%, ce qui indique une biodisponibilité élevée de la fraction du médicament atteignant les poumons. La Cmax dans le plasma est atteinte 5 à 7 minutes après l'inhalation. Le bromure de tiotropium est mal absorbé par le tractus gastro-intestinal. Pour la même raison, la prise de nourriture n’affecte pas l’absorption du tiotropium. Lors de l'ingestion de bromure de tiotropium sous forme de solution, la biodisponibilité absolue était de 2 à 3%; Distribution; liaison aux protéines plasmatiques - 72%. Vd - 32 l / kg. À l'état d'équilibre, la Cmax dans le plasma sanguin des patients atteints de BPCO est de 12,9 pg / ml et diminue rapidement. Cela indique un type de distribution de médicaments à plusieurs compartiments. À l'équilibre, le Cmin tiotropium dans le plasma est de 1,71 pg / ml. Ne pénètre pas dans le BBB. Métabolisme: le degré de biotransformation est négligeable. Ceci est confirmé par le fait qu'après l'administration intraveineuse du médicament, de jeunes volontaires sains dans l'urine ont détecté 74% de la substance inchangée. Le bromure de tiotropium est clivé non enzymatiquement en alcool-N-méthylscopine et en acide dithiénylglycolique, qui ne se lient pas aux récepteurs muscariniques. Quand la recherche est montréeque le médicament (moins de 20% de la dose après administration intraveineuse) soit métabolisé avec la participation des isoenzymes du cytochrome P450, par oxydation puis conjugaison avec du glutathion avec formation de divers métabolites. Des troubles métaboliques peuvent survenir lors de l’utilisation d’inhibiteurs du CYP2D6 et du CYP3A4 (quinidine, kétoconazole et gestodène). Ainsi, les isoenzymes CYP2D6 et CYP3A4 interviennent dans le métabolisme des médicaments. Retrait; La tiotropie T1 / 2 après inhalation varie de 27 à 45 heures La clairance totale pour l’introduction ou lors de l’introduction de jeunes volontaires en bonne santé est de 880 ml / min. Le tiotropium après i / v est principalement excrété par les reins sous forme inchangée (74%). Après l'inhalation d'une poudre sèche à l'état d'équilibre, l'excrétion rénale correspond à 7% par jour de la dose, la partie non absorbée restante étant excrétée par l'intestin. La clairance rénale du tiotropium dépasse la clairance de la créatinine, ce qui indique la sécrétion tubulaire du médicament. Après utilisation à long terme du médicament une fois par jour par les patients atteints de BPCO, l'équilibre pharmacocinétique est atteint au jour 7, sans autre cumul observé. Pharmacocinétique chez des groupes particuliers de patients: Chez les patients âgés, la clairance rénale du tiotropium est réduite (365 ml / min chez les patients atteints de MPOC de moins de 65 ans, à 271 ml / min chez les patients atteints de BPCO de plus de 65 ans). Ces changements n’ont pas entraîné d’augmentation correspondante de l’ASC0-6 ou de la Cmax. Chez les patients atteints de BPCO et d'insuffisance rénale légère (CC 50–80 ml / min), l'inhalation de tiotropium 1 fois / jour à l'état d'équilibre a entraîné une augmentation de la valeur de l'ASC0–6 de 1,8–30%. La valeur de la Cmax est restée identique à celle des patients présentant une fonction rénale normale (CC supérieur à 80 ml / min). Chez les patients atteints de BPCO et d'insuffisance rénale modérée ou grave (CC inférieur à 50 ml / min), l'administration iv de tiotropium a entraîné une double augmentation de la concentration plasmatique (augmentation de 82% de l'ASC0–4 h et augmentation de la Cmax de 52%). par rapport aux patients atteints de MPOC et de fonction rénale normale. Une augmentation similaire de la concentration plasmatique de tiotropium a également été observée après l'inhalation d'une poudre sèche. On suppose que l'insuffisance hépatique n'aura pas d'effet significatif sur la pharmacocinétique du bromure de tiotropium, car le médicament est principalement excrété dans l'urine et la formation de métabolites pharmacologiquement actifs n'est pas associée à la participation d'enzymes.
Des indications
- en tant que traitement d'entretien chez les patients atteints de BPCO, y compris la bronchite chronique et l'emphysème (traitement d'entretien avec dyspnée persistante et pour prévenir les exacerbations).
Contre-indications
- je suis trimestre de grossesse; - enfants et adolescents jusqu'à 18 ans; - hypersensibilité à l'atropine ou à ses dérivés (y compris l'ipratropium et l'oxitropium); - hypersensibilité aux composants du médicament. Avec prudence devrait utiliser le médicament dans le glaucome à angle fermé, l'hyperplasie de la prostate, l'obstruction du col de la vessie.
Utilisation pendant la grossesse et l'allaitement
Les données sur l'utilisation du tiotropium pendant la grossesse chez l'homme sont limitées. Lors d'études chez l'animal, aucun signe d'effet indésirable direct ou indirect sur la grossesse, le développement de l'embryon / du fœtus, l'accouchement ou le développement postnatal n'a été obtenu. Par mesure de précaution, il est préférable de ne pas utiliser le médicament Spiriva; pendant la grossesse. Les données cliniques sur l'utilisation de tiotropium chez les femmes qui allaitent ne sont pas disponibles. Lors d'études précliniques, des données ont été obtenues selon lesquelles une petite quantité de tiotropium est excrétée dans le lait maternel. Spiriva; ne doit pas être utilisé chez la femme enceinte ou allaitante, à moins que le bénéfice escompté ne dépasse pas le risque potentiel pour le fœtus ou l'enfant.
Posologie et administration
Attribuer 1 capsule / jour à la même heure sous forme d'inhalation à l'aide de l'inhalateur HandiHaler; Le médicament ne doit pas être avalé. Spirivu ne doit pas être utilisé plus d'une fois par jour. Les capsules Spiriva ne doivent être utilisées qu'avec un inhalateur HandiHaler; Les patients âgés devraient prendre le médicament aux doses recommandées. Les patients peuvent utiliser le médicament Spiriva pour altérer la fonction rénale. aux doses recommandées. Cependant, une surveillance attentive des patients présentant une insuffisance rénale modérée ou grave et recevant le médicament Spiriva est nécessaire; (comme c'est le cas avec d'autres médicaments, excrétés principalement par les reins). Les patients présentant une insuffisance hépatique peuvent prendre le médicament aux doses recommandées. Méthode d'utilisation de l'inhalateur HandiHaler; Inhalateur HandiHaler; conçu spécifiquement pour l'utilisation de Spiriva et n'est pas destiné à recevoir d'autres médicaments. Un patient peut utiliser son HandiHaler; pour un an. L'inhalateur comprend: un capuchon antipoussière, un embout buccal, une base, un bouton de perforation, une chambre centrale. Utilisation de l'inhalateur HandiHaler::; 1.Ouvrez le capuchon antipoussière en appuyant à fond sur le bouton de perçage, puis en le relâchant. 2. Ouvrez complètement le cache-poussière en le soulevant; puis ouvrez l'embout buccal en le soulevant. 3. Immédiatement avant utilisation, sortez la capsule de Spiriva de la plaquette thermoformée et placez-la dans la chambre centrale (le côté de la capsule placé dans la chambre importe peu); 4. Fermez l'embout jusqu'à ce que vous entendiez un déclic, laissez le capuchon anti-poussière ouvert. 5. tenir un handiHaler; embout buccal vers le haut, appuyez une fois sur le bouton de perçage, puis relâchez-le; ainsi, un trou est formé à travers lequel le médicament est libéré de la capsule lors de l'inhalation. 6. expirez complètement; ne jamais expirer dans l'embout buccal. 7. Prenez HandiHaler; dans la bouche et serrer fermement les lèvres autour de l'embout buccal; En gardant la tête droite, vous devez inspirer lentement et profondément, mais en même temps avec suffisamment de force pour entendre ou sentir les vibrations de la capsule. inhaler jusqu'à ce que les poumons soient complètement remplis; retenez ensuite votre souffle le plus longtemps possible et sortez le HandiHaler; de la bouche; continuez à respirer calmement; répéter les procédures 6 et 7 pour vider complètement la capsule. 8. Ensuite, rouvrez l'embout buccal, retirez et jetez la capsule utilisée. Fermez l'embout buccal et le capuchon antipoussière. Nettoyage de l'inhalateur HandiHaler; HandiHaler nettoyage; doit être effectué 1 fois par mois. Pour ce faire, vous devez ouvrir l'embout buccal et le capuchon antipoussière, puis ouvrir la base de l'appareil en soulevant le bouton de perforation. Rincez soigneusement l'inhalateur dans de l'eau tiède jusqu'à ce que la poudre soit complètement éliminée. HandiHaler; essuyez avec une serviette en papier et laissez l'embout buccal ouvert, la base et le capuchon antipoussière laissent sécher à l'air pendant 24 heures, après quoi, l'appareil est prêt à être utilisé. Si nécessaire, la surface extérieure de l'embout buccal peut être nettoyée avec un chiffon humide mais pas mouillé. Ouverture du blister; Séparez la bande de blister le long de la ligne perforée. Ouvrez la plaquette alvéolée immédiatement avant l'utilisation afin qu'une capsule soit entièrement visible. La capsule contient une petite quantité de poudre, elle n’est donc pas complètement remplie. Si la capsule a été accidentellement ouverte et exposée à l'air, elle ne devrait pas être utilisée.Ni l'appareil ni les capsules blister ne doivent être exposés à des températures élevées, à la lumière du soleil.
Effets secondaires
Métabolisme: déshydratation *. Du côté du système digestif: souvent (≥ 1% et moins de 10%) - la bouche sèche est généralement légère; rarement (≥ 0,1% et moins de 1%) - stomatite, constipation, reflux gastro-oesophagien; rarement (≥ 0,01% et moins de 0,1%) - candidose oropharyngée, gingivite, glossite; obstruction intestinale, y compris iléus paralytique, dysphagie. Du côté du système respiratoire: rarement (≥ 0,1% et moins de 1%) - dysphonie, toux, pharyngite; rarement (≥ 0,01% et moins de 0,1%) - bronchospasme paradoxal, laryngite, sinusite, saignements de nez; Depuis le système cardiovasculaire: rarement (≥ 0,1% et moins de 1%) - fibrillation auriculaire; rarement (≥ 0,01% et moins de 0,1%) - tachycardie (y compris tachycardie supraventriculaire), palpitations; Du système urinaire: rarement (≥ 0,1% et moins de 1%) - difficulté à uriner et rétention urinaire (chez les hommes présentant des facteurs prédisposants), dysurie; rarement (≥ 0,01% et moins de 0,1%) - infections des voies urinaires. Réactions allergiques: peu fréquentes (≥ 0,1% et moins de 1%) - éruptions cutanées; rarement (≥ 0,01% et moins de 0,1%) - urticaire, prurit, réactions d'hypersensibilité, y compris les réactions de type immédiat, œdème de Quincke *. De la peau: infections cutanées et ulcères cutanés, peau sèche *.; De la part du système musculo-squelettique: gonflement des articulations *.; Du côté du système nerveux: rarement (≥ 0,1% et moins de 1%) - vertiges; rarement - (≥ 0,01% et moins de 0,1%) - insomnie. De la part de l'organe de la vision: rarement (≥ 0,1% et moins de 1%) - vision floue; rarement - (≥ 0,01% et moins de 0,1%) - augmentation de la pression intra-oculaire, glaucome. * dans la base de données commune des études cliniques, ces effets indésirables n'ont pas été identifiés; seuls des cas isolés de réactions indésirables associées à une utilisation généralisée du médicament ont été notés; toutefois, le lien avec l’action m-anticholinergique du médicament Spiriva; non prouvé; la fréquence de ces événements rares est difficile à estimer.
Surdose
Symptômes: lors de l’utilisation de doses élevées, des manifestations d’action anticholinergique sont possibles - bouche sèche, troubles de l’hébergement, augmentation de la fréquence cardiaque. Après inhalation d'une dose unique allant jusqu'à 282 mcg chez des volontaires sains, aucun effet anticholinergique systémique n'a été détecté.Après administration répétée d'une dose quotidienne unique de 141 mcg à des volontaires sains, une conjonctivite bilatérale a été observée en association avec une bouche sèche, qui a disparu avec la poursuite du traitement. Dans une étude portant sur les effets du tiotropium lors d’utilisation répétée chez des patients atteints de BPCO ayant reçu un maximum de 36 mcg du médicament pendant plus de 4 semaines, la bouche sèche était le seul effet secondaire. L'intoxication aiguë associée à l'ingestion accidentelle de gélules est peu probable en raison de la faible biodisponibilité du médicament.
Interaction avec d'autres médicaments
Peut-être la nomination de la drogue Spiriva; en association avec d'autres médicaments couramment utilisés dans le traitement de la MPOC: sympathomimétiques, dérivés de la méthylxanthine, GCS par voie orale et par inhalation. L'utilisation combinée avec les bêta-2 agonistes à longue durée d'action, la GCS inhalée et leurs combinaisons n'affecte pas l'action du tiotropium. Des informations limitées sur la co-administration d'anticholinergiques ont été obtenues de deux études cliniques: une dose unique d'une dose de bromure d'ipratropium lors de la prise du médicament Spiriva; chez les patients atteints de BPCO (64 personnes) et chez des volontaires sains (20 personnes) n’a pas entraîné de diminution des effets indésirables, de modification des paramètres vitaux ni d’ECG. Cependant, l'utilisation combinée constante d'anticholinergiques et du médicament Spiriva; non étudié et donc non recommandé.
Instructions spéciales
Le médicament Spiriva; non destiné au soulagement des attaques aiguës de bronchospasme. Des réactions d'hypersensibilité immédiate peuvent survenir après l'inhalation de Spiriva en poudre. Le processus d'inhalation de Spiriva (ainsi que d'autres médicaments inhalés) peut provoquer un bronchospasme. Les patients présentant une insuffisance rénale (CC ≤ 50 ml / min) doivent être étroitement surveillés lors de l'administration de Spiriva.; Les patients doivent être familiarisés avec l'utilisation de l'inhalateur. Ne laissez pas la poudre pénétrer dans les yeux. Une douleur ou un inconfort oculaire, une vision floue, des halos visuels associés à des yeux rouges, une stagnation de la conjonctive et un œdème cornéen peuvent indiquer une attaque aiguë du glaucome à angle fermé. Avec le développement de toute combinaison de ces symptômes, le patient doit immédiatement consulter un médecin.L'utilisation de médicaments causant le myosis n'est pas un traitement efficace dans ce cas. Une capsule contient 5,5 mg de lactose monohydraté. Impact sur l'aptitude à conduire des véhicules et sur les mécanismes de contrôle: Aucune étude sur l'effet du médicament sur l'aptitude à conduire des véhicules et sur les mécanismes de contrôle n'a encore été réalisée. Les cas de vertiges et de vision trouble lors de l'utilisation du médicament peuvent avoir un impact négatif sur les capacités susmentionnées.
Oui